Alkalifluoride+ Alkalibichromate:
Adolit U 15
Akarifix U
Akarifix ULL
Basilit UK, -UU, -U
Corbal U
Corbal U15
Impralit UG, -U, U extra
Wolmanit TS, -U, -U hochlöslich, U-Reform
6, -U-Reform 1
Xylogen Salz U
Alkalichromat + Borat + Kupfersalze:
Basilit CCB
Alkalichromat + Silicofluorid + Kupfersalz:
Basilit CFK
Silicofluoride:
Adexin SF
Akarifix 3 J
Gisal bitox
HV 3-Holzschutzsalz
Hydrasil Doppel
Kulbasal J, -SF
Osmol RS
Hydrogenfluoride:Adolit TS
Akarisit
Basilit TS
Corbal 100
HV 4--Holzbocksalz
Hydrasil 616, -TS
Impralit BF, -TS
Kulbasal HB
Osmol WB 4 spezial
Wolmanit BF
Borsalze:
Adolit B
Aglaia Holtimprägniergrund
Auro
Borsalz-Holzimprägnierung
4.2.3.1.1 Allgemeines
Eingesetzt seit der Jahrhundertwende. Wäßrige
Lösungen von Fluorsalzen geben Spuren von HF ab, daher keine Einsetzbarkeit
für Innenräume.
4.2.3.1.2 Toxikologie
hepatotoxisch, ätzend, Osteofluorose (Skelettschädigung);
Enzymhemmung; Speicherung im Knochengewebe als Fluorid; wegen der
hohen Wasserlöslichkeit von Fluor erfolgt die Aufnahme über
die feuchten Schleimhäute mit Folge einer heftigen Schädigung
des oberen Respirationstraktes, die sehr schlecht abheilt.
4.2.3.1.3 Akute Vergiftungssymptome
Atemnot, Husten, Bronchitis, Übelkeit, Erbrechen,
Kopfschmerzen, Krämpfe, Lähmungen, Geschwüre
4.2.3.1.4 Chronische Vergiftungssymptome
Stoffwechselstörungen, Leber- und Nierenschäden,
Gewichtsverlust, Anämie, Gelenkerkrankungen, Lungenödeme
durch FKW (Fluorkohlenwasserstoffe)
4.2.3.1.5 Physikalisch-chemische Eigenschaften
NaF
Allgemeine Eigenschaften:
farblose Kristalle
rel. Molekülmasse: 41.99
Schmelzpunkt [ grad C]: 993
Siedepunkt[ grad C]: 1695
Löslichkeit in Wasser (20 grad C) [g/L]: 42.2
KF
Allgemeine Eigenschaften: farblose Kristalle
rel. Molekülmasse: 58.1
Schmelzpunkt[ grad C]: 858
Siedepunkt[ grad C]: 1505
Löslichkeit in Wasser (20 grad C) [g/L]: 923
BF3
Allgemeine Eigenschaften: farbloses Gas
rel. Molekülmasse: 67,81
Schmelzpunkt [ grad C] : -126,7
Siedepunkt [ grad C]: -99,9
Löslichkeit in Wasser (20 grad C) [g/L]: 1060
HF (35,35%) + Wasser (Flußsäure)
Allgemeine Eigenschaften: farblose Flüssigkeit
rel. Molekülmasse: --
Schmelzpunkt [ grad C]: --
Siedepunkt [ grad C]: konstant siedend bei 120
Löslichkeit in Wasser (20 grad C) [g/L]:--
4.2.3.1.6 Grenzwerte [15]:
MAK (HF, F und Fluoride)
______________________________________________________________
[mL/cbm] [mg/cbm] Stoff: Bemerkungen:
______________________________________________________________
-- 2,5 Alkalifluoride G
(als Fluor berechnet)
Spitzenbegrenzung: II, 2
______________________________________________________________
3,0 2,0 HF H
Spitzenbegrenzung: I
______________________________________________________________
1,0 3,0 BF3
Spitzenbegrenzung: I
______________________________________________________________
0,1 0,2 Fluor
Spitzenbegrenzung: I
______________________________________________________________
Wert Untersuchungs- Probennahme- Stoff
material zeitpunkt
______________________________________________________________________
7,0 Ha b) HF und Fluoride
(Kreatinin)
4,0 Ha d) HF und Fluoride
(Kreatinin)
______________________________________________________________________
rel. Molekülmasse: 136.28
Schmelzpunkt [ grad C]: 282
Siedepunkt [ grad C]: 732
Löslichkeit in Wasser (20 grad C) [g/L]: 4320
Zinkverbindungen
MAK
______________________________________________
[mL/cbm] [mg/cbm] Stoff:
______________________________________________
-- 5,0 F ZnO-Rauch
Spitzenbegrenzung: III
______________________________________________
nicht festgesetzt ZnCl(2)
______________________________________________
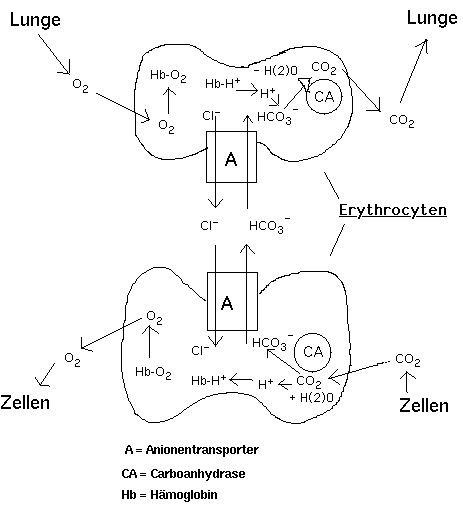
***Wirkungsmechanismus: Das Arsenatanion benutzt einen sog. Anionentransporter , um in das Zellinnere zu gelangen. Dieser ist ein 94 kD - Protein in der Erythrocytenmembran und macht mit 20 bis 30 % einen großen Teil der Membranproteine selbst aus. In der Membran eines einzelnen Erythrocyten befinden sich ca. 1,2 x 10 h6 Anionentransporter. Für die Toxikologie ist dieses Protein so wichtig, weil es nicht nur physiologische Anionen wie Hydrogencarbonat, Chlorid und Phosphat in die Zelle tranportiert, sondern auch die Permeation toxischer Anionen wie Vanadat-, Chromat-, Arsenat- und Superoxidanionen ermöglicht. In der Zwischenzeit wurde das Protein nicht nur in Erythrocyten, sondern auch in Epithelzellen der Niere, der Lunge und des Darmes sowie in Zellen von Leber, Gehirn, Herz und in weißen Blutkörperchen gefunden.
Zur Erklärung der Funktionsweise des Anionentransporters und der schematischen Darstellung des CO(2)- bzw. O(2)-Transportes durch die Erythrocyten siehe ---> folg. Abbildung (Erklärung im Text):

Erklärung der Abbildung 1:
1. Vorgänge in der Zelle:
- Erst in den Erythrocyten wird aus CO(2) und H(2)O mit Hilfe
des Enzyms Carboanhydrase (CA) Kohlensäure H(2)CO(3) gebildet,
das sofort aufgrund des Dissoziationsgleichgewichtes in HCO(3)(-)
und H(+) dissoziiert.
- Die eigentliche Aufgabe des Anionentransporters (A) ist die Aufrechterhaltung der Hydrogencarbonatkonzentration in den Erythrocyten. Die geringe Löslichkeit von CO(2) im Blut bringt es mit sich, daß der größte Teil (ca. 81%) des abgeatmeten Kohlendioxids in Form von Kohlensäure zu den Lungen transportiert werden muß. Dies geschieht, indem zunächst die Zellen im Blut gelöstes CO(2) aufnehmen und mit Hilfe der Carboanhydrase (CA) -einem sehr wirksamem zinkhaltigem Enzym- und Wasser in Hydrogencarbonat umwandeln.
- Das bei der Dissoziation der Kohlensäure gebildete H(+) wird vorwiegend durch Bindung an Hämoglobin unter Abgabe von O(2) gepuffert [6; S. 147] . An dieser Stelle ist, wie auch bei der Abgabe des CO(2) in der Lunge, der O(2)-Transport mit dem CO(2)-Transport gekoppelt. Das gebildete O(2) wird aus der Zelle abgegeben. Das in der Zelle gebildete Hydrogencarbonat wird ebenfalls über den Anionentransporter ausgeschleußt und dafür Cl(-) eingeschleußt bis auf beiden Seiten der Membran nahezu gleiche Konzentrationen vorhanden sind.
2. Vorgänge in der Lunge:
In den Lungen geschieht der umgekehrte Prozeß:
- O(2) wird zunächst durch Bindung an das Hämoglobin aufgenommen, wobei H(+) gebildet wird. CO(2) ensteht durch Dissoziation des Hydrogencarbonates mit Hilfe der Carboanhydrase und des vorher entstandenen H(+) und wird aus der Zelle durch Abatmung abgegeben.
- Der gebildete Konzentrationsgradient in den Zellen der Lunge bewirkt die Aufnahme von Hydrogencarbonationen in die Erythrocyten und die Abgabe von Cl(-) bis zur Einstellung des Konzentrationsgleichgewichtes.
-Durch die Protonenabgabe des Hämoglobins wird gleichzeitig die Affinität des Hämoglobins für O(2) erhöht.
Der Anionentransporter sorgt also für die Aufrechterhaltung der Hydrogencarbonat-Gleichgewichts-Konzentration bzw. wegen der Folgereaktionen auch für den Ablauf der Atmung im Organismus.
Das oben erwänte Enzym Glycerinaldehyd-3-phosphat-Dehydrogenase (GADPH) nimmt bei der Glykolyse eine Schlüsselstellung ein, indem es Glycerinaldehyd-3 -phosphat zu 1,3-Bisphosphoglycerat oxidiert und dabei ein anorganisches Phosphatmolekül in eine energiereiche Bindung überführt (1,3-Biphosphoglycerat), die dann zur ATP-Gewinnung genutzt wird:
(Glycerinaldehyd-3-phosphat)2- + (NAD)+ +( HPO4)2- <---GADPH---> (1,3-Biphosphoglycerat)4- + NADH + H+
(1,3-Biphosphoglycerat)4- + (ADP)3- ---> (3-Phosphoglycerat)3- + (ATP)4-
In dieser Reaktion kann das Phosphation [HPO(4)](2)(-) durch Arsenat [HAsO(4)](2)(-) ersetzt werden, das entstehende 1-Arseno-3-Phosphoglycerat ist aber labil und zerfällt in 3-Phosphoglycerat und Arsenat, so daß die Substratkettenphosphorylierung unterbrochen wird:
Glycerinaldehyd-3-phosphat(2)(-) + [NAD](+) + [HAsO(4)](2)(-) + H(2)O <---GADPH---> 3-Phosphoglycerat(3)(-) + NADH + 1-Arseno-3-phosphoglycerat(4)(-) + 3 H(+)
Damit steht kein 1,3-Bisphosphoglycerat zur ATP-Gewinnung zur Verfügung:
1-Arseno-3-phosphoglycerat(4)(-) ---> 3-Phosphoglycerat(2)(-) + [HAsO(4)](2)(-) (keine ATP-Bildung)
Aus der Phosphatgruppe im 3-Phosphoglycerat läßt sich lediglich die zuvor aus ATP stammende Energie zur Bildung von Glycerinaldehyd-3-phosphat zurückgewinnen.
4.2.3.3.3 Akute Vergiftungssymptome:
Verdauungsstörungen, Durchfall, Muskelkrämpfe,
Husten, Kopfschmerzen
4.2.3.3.4 Chronische Vergiftungssymptome:
Nervenschäden, Schwäche, Hypotonie, Haarschwund,
Kreislaufkollaps, Herz- und Atemlähmung, Gefühllosigkeit und
Kribbeln der Glieder, dunkle Hautpigmentierung, Rückbildung des
Knochenmarks, Lungenödem, Gelenkschmerzen, Lähmungen, Leber-
und Nierenschäden
4.2.3.3.5 Physikalisch-chemische Eigenschaften:
Ca(3)[AsO(4)](2) x 3 H(2)O
Allgemeine Eigenschaften: farloses amorphes Pulver
rel. Molekülmasse: 398.08
Schmelzpunkt [ grad C]: 1.5
Siedepunkt: --
Löslichkeit in Wasser (20 grad C): 0.13 g/L
H(3)AsO(4) x 1/2 H(2)O
Allgemeine Eigenschaften: weiße, durchscheinende, hygroskopische
Kristalle
rel. Molekülmasse: 150.95
Schmelzpunkt[ grad C]: 35.5
Siedepunkt[ grad C]: 160 (-H(2)O)
Sättigungsdampfdichte:
Löslichkeit in Wasser (20 grad C) [g/L]: 6300
As(2)O(5)
Allgemeine Eigenschaften: weiße, durchscheinende Kristalle
rel. Molekülmasse: 229.84
Schmelzpunkt[ grad C]: 315 (Zersetzung)
Siedepunkt[ grad C]: --
Löslichkeit in Wasser (20 grad C) [g/L]: 1500
As(2)O(3)
Allgemeine Eigenschaften: amorphe, glasartige Substanz
rel. Molekülmasse: 197.84
Schmelzpunkt [ grad C]: 312.3
Siedepunkt[ grad C]: --
Löslichkeit in Wasser (20 grad C) [g/L]: 37.0
4.2.3.3.6 Grenzwerte [15]: (Arsenverbindungen:)
MAK
Gefahrenklasse: III A1, daher kein MAK-Wert
Bermerkungen:Analytische Unterscheidungen der As-Verbindungsarten sind kaum möglich. Daher wird der Gehalt des Elementes als zu untersuchende Größe zugrundegelegt. Da nicht erwiesen ist, ob krebserzeugende Verb.en im Arbeitsbereich vorliegen, wird empfohlen, den TRK-Wert anzuwenden.
TRK 0,1 G [mL/cbm]
Bemerkungen: selber Wert für As(2)O(3), As(2)O(5); H(3)AsO(3),
H(3)AsO(4) und deren Salze
4.2.3.3.7 Literatur:
[4] E. Merian (Hrsg.): Metalle in der Umwelt. Verlag
Chemie, Weinheim 1988
[5] W. Wirth, C. Gloxhuber: Toxikologie. Georg Thieme Verlag,
New York 1989
[6] G. F. Fuhrmann: Allgemeine Toxikologie für Chemiker.
Teubner Verlag, Marburg 1994
[15] H. Tiesler (Hrsg.): Gefahrenstoffe 1993.Universum Verlagsanstalt,
Wiesbaden 1993
rel. Molekülmasse: 99,90
Schmelzpunkt [ grad C]: 198
Siedepunkt [ grad C]: >230 (Zers.)
Dampfdruck (bei 20 grad C) [hPa]: --
Sättigungsdampfdichte: --
Löslichkeit in Wasser (20 grad C) [g/L]: 617
PbCrO(4) x PbO
Allgemeine Eigenschaften: rote Kristalle
rel. Molekülmasse: 546,37
Schmelzpunkt [ grad C]: --
Siedepunkt [ grad C]: --
Dampfdruck (bei 20 grad C) [hPa]: --
Sättigungsdampfdichte: --
Löslichkeit in Wasser (20 grad C) [g/L]: unlösl.
CaCrO(4) x 2 H(2)O
Allgemeine Eigenschaften: gelbe, monokline Prismen
rel. Molekülmasse: 192,07
Schmelzpunkt [ grad C]: 200 (-2 H(2)O)
Siedepunkt [ grad C]: --
Dampfdruck (bei 20 grad C) [hPa]: --
Sättigungsdampfdichte: -- Löslichkeit in Wasser
(20 grad C) [g/L]: 163
SrCrO(4)
Allgemeine Eigenschaften: gelbe, monokline Kristalle
rel. Molekülmasse: 203,61
Schmelzpunkt [ grad C]: --
Siedepunkt [ grad C]: --
Dampfdruck (bei 20 grad C) [hPa]: --
Sättigungsdampfdichte: --
Löslichkeit in Wasser (20 grad C) [g/L]: 1,2
K(2)CrO(4)
Allgemeine Eigenschaften: gelbe, rhombische Kristalle
rel. Molekülmasse: 194,2
Schmelzpunkt [ grad C]: 968,3
Siedepunkt [ grad C]: --
Dampfdruck (bei 20 grad C) [hPa]: --
Sättigungsdampfdichte: --
Löslichkeit in Wasser (20 grad C) [g/L]: 629
K(2)Cr(2)O(7)
Allgemeine Eigenschaften:
rote, monokline oder trikline Kristalle
rel. Molekülmasse: 294.17
Schmelzpunkt [ grad C]: (tricl. --> monokl.: 241,6) 398
Siedepunkt [ grad C]: 500
Dampfdruck (bei 20 grad C) [hPa]: --
Sättigungsdampfdichte: --
__________________________________________________________________________
Chromverbindungen [mL/cbm] [mg/cbm] Stoff: Bemerkungen:
__________________________________________________________________________
TRK (BRD) -- 0,1 G Chrom(VI)-Verb.en K III B
(Cr-, Sr-, Zn- Chromat) M
ausser den wasser-
unlöslichen Salzen
-- 0,2 CrO(3) K III A2
-- -- Pb-Chromate K III A2
Ba-Chromate
(allg. schwerlösl.
Salze)
-- -- Chromcarbonyl III B
MAK (Schweiz) 0,05 -- CrO(3) und Chromate
__________________________________________________________________________
4.2.3.4.8 Literatur:
[4] E. Merian (Hrsg.): Metalle in der Umwelt. Verlag
Chemie, Weinheim 1984,
[7] Josef Velvart: Toxikologie der Haushaltsprodukte. Verlag
Hans Huber, Zürich 1988
[9] M. Daunderer: Umweltgifte; Kompendium der klinischen Toxikologie;
Teil 3, Band 13. ecomed Verlagsgesellschaft, München 1990
[15] H. Tiesler (Hrsg.): Gefahrenstoffe 1993.Universum Verlagsanstalt,
Wiesbaden 1993