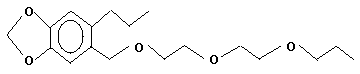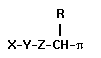4. Holzschutzmittel (HSM)
4.4: Insektizide (Teil 5): Pyrethroide
Inhaltsverzeichnis Teil 5
Ca. 2000 Pflanzenarten produzieren körpereigene insekttötende
Wirkstoffe, von denen bislang lediglich in wenigen Fällen Reindarstellungen
und Strukturaufklärungen gelangen. Die technische Nutzung ist nur
beschränkt möglich.
Eine kommerziell eingesetzte Gruppe derartiger insektizider Pflanzeninhaltsstoffe
sind die Pyrethrine, das sind Inhaltsstoffe der margaritenähnlichen
Blumen Chrysanthemum cinerafolis und Chrysanthemum coccineum
, und deren synthetische Abkömmlinge, die Pyrethroide
. Durch Zusatz von z.B. Piperonylbutoxid (Formel s.u.) oder
anderer wirkungsvoller Substanzen zu den Pyrethrinen erzielt man eine
wesentlich höhere Toxizität als durch Addition beider Wirkungen
zu erwarten wäre und erhält so die sog. Synergisten
, deren genauer Wirkungmechanismus noch unklar ist.
Pyrethrine werden durch Extraktion aus den getrockneten Blüten
einiger landwirtschaftlich angebauter Chrysantemumarten gewonnen, in denen
Pyrethrum, ein Wirkstoff aus vier Estern (Pyrethrin I, Pyrethrin II,
Cinerin I, Cinerin II), zu ca. 1,3 % enthalten ist. Die Pyrethrine haben
nur geringe Warmblütertoxizität und eignen sich gut für
den Einsatz als Insektizid im Haushalt. Sie sind empfindlich gegenüber
Einflüssen wie Licht, Wärme und Sauerstoff und haben sehr
kurze Karenzzeiten. Resistenterscheinungen sind selten.
Der Anbau der Blüten geschieht vorwiegend in Tansania
und Kenia (23.000 t pro Jahr).
Pyrethrine:
Struktur der Pyrethrine:
Chemisch gesehen sind Pyrethrine monocyclische Terpene, deren
charakteristische Guppe ein C 3-Ring ist:
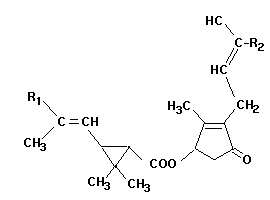 Folgende Derivate werden charakterisiert:
Folgende Derivate werden charakterisiert:
Natürliche Pyrethrine:
_______________________________________
R1 R2
_______________________________________
Pyrethrin I -CH3 -CH=CH2
Pyrethrin II -COOCH3 -CH=CH2
Cinerin I -CH3 -CH3
Cinerin II -COOCH3 -CH3
Jasmolon I -CH3 -CH2-CH3
Jasmolon II -COOCH3 -CH2-CH3
_______________________________________
Die zu Staub verarbeiteten, getrockneten Blüten stellen
die ursprüngliche handelsübliche Ware dar. Als Extraktionsmittel
werden Kerosin/Methanol , Petrolether/Acetonitril oder Petrolether/Nitromethan
verwendet. Der als Insektizid wirksamste Bestandteil des Pyrethrumgemisches
ist Pyrethrin I. Es ist ca. 100 mal giftiger als die anderen Bestandteile.
Am schnellsten betäubend wirkt Pyrethrin II.
Da die Pyrethrine licht-, luft- und wärmeempfindlich sind,
werden Antioxidantien, UV-Absorber, Zusätze wie Borverbindungen
oder Kieselgel und andere organische Träger zugesetzt. Durch Zusatz
von hochsiedenden Ölen wie Glycerinester, Polysiloxanen, Squalen
etc. wird die Flüchtigkeit vermindert und die Dauerwirsamkeit erhöht.
Da die Pyrethrine zu instabil in der Athmosphäre sind,
werden sie kaum in der Landwirtschaft,sondern hauptsächlich im Vorratsschutz
und im Hygienebereich eingesetzt.
Synergisten:
Für sich allein sind die Synergisten gegen Insekten und Warmblüter
untoxische Verbindungen. Durch Zusammenwirkung mit Pyrethrinen entstehen
Wirkstoffkombinationen, welche durch Hemmung der Oxidasen oder
Cytochrom P 450
die metabolische Stabilität der eigentlichen Wirkstoffe verbessern
oder die Penetrierbarkeit der Zellmembranen stark erhöhen. Dadurch
läßt sich teures Pyrethrum einsparen und evt. Resistenzen
bei Insekten aufheben. Der bekannteste Synergist ist Piperonylbutoxid:
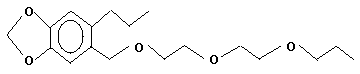
Toxizität von Piperonylbutoxid:
_________________________________________
LD(50) >7500 mg/kg (Ratte, or.)
ADI 0,03 mg/kg KG/d
_________________________________________
Weitere Synergisten sind (entsprechende Formeln siehe
[20], S.3-6):
Safroxan,
Sesamex,
Sesamin,
Piperin,
Propylisome,
Sulfoxid,
Tropital,
Derivate des Propargylalkohols, aber auch einige Ether
(z.B. CH(3)-O-[CH(2)](2)-CH(2)-OH ),
Phosphorsäureester der Formel
Ph-O-PS-[-O-C(2)H(5)](2)
oder Ph-CH(2)-S-PO-(O-iso-Prop.)(2),
substituierte Azol-Derivate,
Pinonester,
Dimethylformamid,
Capryldiethylamid,
Isopropylester der ungesätigten C(12)- bis C(18)-Carbonsäuren,
Diarylamin,
langkettige cyclische Imide,
u.a.
Synergistische Effkte werden auch durch Zumischen anderer Insektizide
, ja sogar durch Zumischen eines anderen oder mehrerer anderer Pyrethroide
oder gar von formelgleichen Stereoisomeren erhalten.
Die Potenzierung der Wirkung wird in der Patentliteratur ebenfalls
als Synergismus bezeichnet und wird dort auch für Mischung der Pyrethroide
mit Carbamaten oder Mischungen spezieller Isomerenverhältnisse beansprucht.
Zumindest im Laborversuch erwiesen sich die Anwesenheit der
insektizid unwirksamen oder nur schwach wirskamen Stereoisomeren der
entsprechenden wirksamen Pyrethroide als antisynergistisch.
Pyrethroide:
Seit den 50er Jahren sind synthetische Produkte (Pyrethroide)
auf dem Markt, von denen das Allethrin (Estergemisch aus Allethonol
und Chrysantemumsäure) als erstes im größeren Maßstab
hergestellt wurde [12]
, [20]
:
Pyrethroide :
____________________________________________________________________________________
Substanz relative Wirkung LD(50) (Ratte, p.o.)
[mg/kg]
____________________________________________________________________________________
-Pyrethrin I (s. Abb.) 1 340
NOEL 10 mg/kg KG
ADI 0,04 mg/kg KG/d)
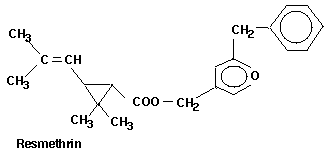
-Resmethrin (s. Abb.) 21 1500
-Permethrin (s. Abb.) 30 1750
Toxizität gegen Musca domestica (Hausfliege):
1S cis 8
1R cis 160-320
1S trans 1
1R trans 74-88
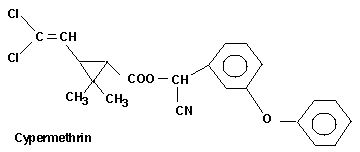
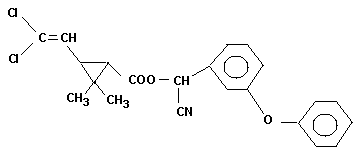
-Cypermethrin (s.Abb.) 33 300
-Dekamethrin 1150 60
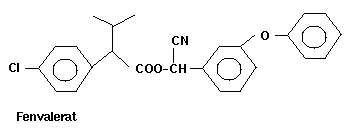
-Fenvalerate 22 400
-Fluvalinate 25 --
_____________________________________________________________________________________
Einige Strukturformeln der Pyrethroide (ohne Berücksichtigung
der absoluten Konfiguration):
Chemische Charakterisierung und Variationsfähigkeit
der Pyrethroide:
Pyrethroide lassen sich durch folg. allgemeine Formel schematisieren:
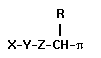
mit
- X = lipophiles zwei- und mehratomiges pi-System (Vinylgruppe
etc.), aber auch Ether
- Y =Gruppierung mit der Raumerfüllung, absoluten Konfiguration
und Lipophilie folgender Teilstrukturen (die cis-Konfiguration der Methyl-
zur Ester-Gruppe ist für die insektizide Wirkung unerläßlich):

- Z = zweiatomige Brücke (optimal ist die Ester-Bindung
-COO-)
- R = CN- oder Ethinyl (siehe entsprechende Formel der jeweiligen
Verbindung)
- "pi" = weiteres lipophiles substituiertes pi-System (Aryl,
Hetroaryl, Olefin), verbunden über die Gelenkgruppe O, S oder CH(2)
Biologische Effekte der Pyrethroide:
nichtsystemische Wirkung; starke Kontakt- und Fraßgiftwirkung,
sowie Repellenteigenschaften. Einige Vertreter sind toxisch gegen Warmblüter
bei oraler Verabreichung, insbesondere die Ester der 1-R-cis-Isomeren
der Cyclopropancarbonsäure-Derivate, sowie der S-konfigurierten
alpha-Phenyl- isovaleriansäure. Die entsprechenden trans-Isomeren
sind weniger toxisch. Bei intravenöser Gabe sind alle Pyrethroide
sogar hochtoxisch gegen Tiere aller Art.
Da die Isomeren derselben Verbindung sich in ihrer Wirkung
gegenseitig beeinflussen und sich physiologisch sehr unterschiedlich verhalten,
ergibt sich ein sehr verwirrendes Bild der Toxikologie.
Es wurde Untersuchungen am isolierten Axon und am lebenden Insekt
durchgeführt. Die Untersuchungen des physiologischen Verhaltens
ergaben, das einige stark insektizid wirksame Isomere am isolierten Axon
kaum wirksam waren, während andererseits schwach insektizid wirksame
Isomere gefunden wurden, welche in hohem Masse die Nervenmembran erregen.
Wahrscheinlich ist eine synaptische Wirkung mit noch unbekannten Neurotransmittern.
Bei tieferen Temperaturen höhere Wirksamkeit als bei niedrigen
Temperaturen. Veränderungen der durch die Natur vorgegebenen absoluten
Konfiguration der chiralen Zentren führt zum teilweisen oder totalen
Verlust der Wirkung.
Wirkungen auf den Menschen:
Wegen schlechter Resorbierbarkeit der Wirkstoffe im Magen-Darm-Bereich
geringe Toxicität bei oraler Aufnahme. Erfolgt die Aufnahme jedoch
direkt in das Blut, dann sind die Pyrethroide und Pyrethrum auch für
den Menschen sehr giftig, da sie ihren Wirkort - die Nerven - ohne vorherige
Entgiftung erreichen.
Von der gesunden Haut werden Pyrethroide nur schlecht aufgenommen, jedoch
ist das Resorptionsvermögen von etwaigen Vorschädigungen
der Haut (Verletzungen, Allergien) abhängig, ebenso wie von der
Formulierung des Wirkstoffs. Das gilt auch für die Aufnahme über
den Magen-Darm-Bereich. Z.B. erwies sich in Maisöl gelöstes
Permethrin im Fütterungsversuch an Ratten gegenüber in Wasser
gelöstem Permethrin als sechsmal so giftig
[66]
.
Offenbar ist das Vorhandensein einer alpha-Cyano-Gruppe in Bezug
auf das COO-Molekül am stark gespannten C-3-Dreiring in der chemischen
Struktur der Pyrethroide von wichtiger Bedeutung. Diese Cyanogruppe führt
zu
Zwei Pyrethroid-Typen mit unterschiedlicher Wirkungssymptomatik
[66]
:
Bioallethrin
Permethrin
Resmethrin
usw.
Typische Symptome:
Muskelzittern
Überregbarkeit
Störung der Bewegungskoordination
Krämpfe
sog. T-Syndrom (Tremor = Muskelzittern)
- Symptome haben Ähnlichkeit mit DDT-Vergiftung
Deltamethrin
Fenvalerat
Cyfluthtrin
Cypermethrin
usw.
Typische Symptome:
Muskelzuckungen
Überschußbewegung
sog. CS-Syndrom (
Choreoatheose
und Salivation
)
- Symptome haben Ähnlichkeit mit Lindan-Vergiftung
Geschichte der Pyrethroide:
Anwendung seit Beginn des 19. Jhrd.s als Insektenpulver ("Dalmatinisches"
oder "Persisches Pulver"). Auklärung der Struktur während
des 1. Weltkrieges durch Ruzicka und Staudinger, denen
auch die Herstellung synthetischer Pyrethroide gelang. Unklarheiten bezüglich
der Strukturformel wurden 1947 durch LaForge (USA) beseitigt.
1954 beantwortete Harper (England) die stereochemische Frage
der Chrysantemensäure und 1972 gelang Crombie die Klärung
der Stereochemie der natürlichen Alkoholkomponente.
In den zwanziger Jahren erfolgte die Anlegung der großen
Pyrethrum-Plantagen in Kenia, wobei es zur Anwendung als Schutzmittel
für Getreide kam. Im 2. Weltkrieg kam Pyrethrum in Form von Aerosolbomben
zur Malariabekämpfung aus der Luft zum Einsatz.
1947 erfolgte die Synthese von Allethrin durch LaForge
und Schlechter. 1962 fand Kato (Japan), daß
N-Hydroxyphtalimid -Derivate schnelle Wirkungen hatten (knock-down-Wirkung),
wodurch das Tetramethin entstand. Stete Steigerung der Struktur-Aktivität
führte 1965 zum 5-Benzyl- 3-furyl-carbinol (Resmethrin).
In den Pflanzenschutzlaboratorien der Firma Shell wurde durch
Searle 1971 der starke Wirkungszuwachs der m-Phenoxybenzyl-Chrysantemate
durch Einführung einer Cyan-Gruppe entdeckt. Der Ersatz der
trans-ständigen Methylseitengruppe in der Isopropyliden-Gruppe am
C- 3-Ring durch eine Butadienyl-Seitenkette verstärkte die Wirksamkeit
der Insektizide, ergab aber immer noch photo- und wärmelabile Verbindungen.
Erst die Entdeckung der Permethrinsäure durch Elliott
, der Methylgruppen (s. Formel) durch Chlor ersetzte und die Cyclopropancarbonsäure
mit m-Phenoxybenzylalkohol veresterte, führte auf erste wirklich
photostabile Verbindungen und ergab landwirtschaftlich nutzbare hochaktive
Pyrethroid-Insektizide.
Mit der Reindarstellung des Dekamethrins und des Cypermethrins
gelang die Herstellung der bislang überhaupt potentesten
Insektizide mit einer neuen Größenordnung der Wirksamkeit !
Ohno fand 1972 heraus, daß die bislang als unverzichtbar
angesehene Chrysantemumsäureanalogen durch einfachere, sterisch
äquivalente, photostabile alpha-(4-Chlor-phenyl)-Isovaleriansäuren
ersetzbar sind womit man kam damit zum Fenvalerat (s. Formel oben)
durch Yoshioka . Es erfolgten noch weitere Steigerungen
der insektiziden Wirkungen durch chemische Veränderungen, die vor
allem mit dem Namen Naumann bei Bayer in Verbindung gebracht
wird.
Der erste probeweise Einsatz der neuen photostabilen Pyrethrooide
in den Großkulturen (z.B. Baumwolle) erfolgte 1977 durch die Konzerne
Shell und ICI. In kurzer Zeit gelang bis zum Jahre 1980
eine Beteiligung am Insektizid-Weltmarkt in Höhe von 30 %.
In der folgenden Liste soll ein Vergleich der Toxizitäten
der verschiedenen Insektizid-Typen erfolgen. Die aufgeführten relativen
Toxizitäten schwanken wegen der starken Streuung publizierter Daten.
Es handelt sich also bei den aufgeführten Daten um vorsichtig zu
betrachtende Mittelwerte. Der Vergleich der relativen Toxizitäten
für Warmblüter (Ratten) und Insekten (Hausfliege) demonstriert
die (orale !!, ---> s.o.
) relative Ungefährlichkeit der Pyrethroide für Warmblüter
(Menschen). Die Werte besagen, daß z.B. Dekamethrin oral eingenommen
für Fliegen 5320 mal giftiger ist als für Ratten.
Relative Toxizitäten verschiedener Insektizidtypen:
[20]
______________________________________________________________________________
Insektizid
Gegen: Toxizitätsverhältnis:
Hausfliege Baumwoll-
insekten LD(50) (Ratte,or.)/LD(50)(Fliege)
______________________________________________________________________________
Malathion 0,2 -- 50
DDT 1 1 11
Carbaryl -- 1 --
Parathion 3 1,5 9
Dimethoate 5 -- 389
Pyrethroide:
______________________________________________________________________________
Pyrethrine 1 -- 74
Permethrin 5 10 --
Cypermethrin 10 25 --
Fenvalerat 4 20 --
Dekamethrin 100 100 5320
______________________________________________________________________________
Die Forschung der chemischen Industrie suggeriert den Eindruck,
daß Pyrethroide harmlos für Warmblüter bzw. Menschen
seien. Dieser Eindruck beruhte auf der Tatsache, daß bis vor wenigen
Jahren wenig über Vergiftungsfälle mit Pyrethroiden bekannt
war, bis 1989 ein chinesisches Ärzteteam 573 Fälle akuter Pyrethroidvergiftungen
in China erstellte. 229 der Fälle ließen sich auf Expositionen
beim Besprühen landwirtschaftlich genutzter Felder mit Pyrethroiden
zurückführen. 344 Fälle wurden durch Unfälle, im
wesentlichen durch versehentliche orale Aufnahme, verursacht
[21]
.
 Ambush
Ambush
Stockade
Outflank
Stomoxin
Pounce
Talcord
Ectiban
Blockade der Funktion des Natrium-Kanals in
den Nervenmembranen. Da die Isomeren derselben Verbindung sich in ihrer
Wirkung gegenseitig beeinflussen und sich physiologisch sehr unterschiedlich
verhalten, ergibt sich ein sehr verwirrendes Bild der Toxikologie.
Es wurde Untersuchungen am isolierten Axon und am lebenden Insekt durchgeführt.
Die Untersuchungen des physiologischen Verhaltens ergaben, das einige
stark insektizid wirksame Isomere am isolierten Axon kaum wirksam waren,
während andererseits schwach insektizid wirksame Isomere gefunden
wurden, welche in hohem Masse die Nervenmembran erregen. Wahrscheinlich
ist eine synaptische Wirkung mit noch unbekannten Neurotransmittern.
Bei tieferen Temperaturen höhere Wirksamkeit als bei höheren
Temperaturen. Veränderungen der durch die Natur vorgegebenen absoluten
Konfiguration der chiralen Zentren führt zum teilweisen oder totalen
Verlust der Wirkung.
Wirkungen auf den Menschen:
Wegen schlechter Resorbierbarkeit der Wirkstoffe im Magen-Darm-Bereich
geringe Toxizität bei oraler Aufnahme, da Entgiftungen über
die Leber stattfinden. Erfolgt die Aufnahme jedoch direkt in das Blut
oder auf anderem Weg, ohne den Entgiftungsprozess über die Leber (z.B.
über die Atmung oder über die Haut) zu nehmen, dann sind die
Pyrethroide (und auch Pyrethrum !!) auch für den Menschen sehr giftig,
da sie ihren Wirkort - die Nerven - ohne vorherige Entgiftung erreichen.
Von der gesunden Haut werden Pyrethroide nur schlecht aufgenommen, jedoch
ist das Resorptionsvermögen von etwaigen Vorschädigungen
der Haut (Verletzungen, Allergien) abhängig, ebenso wie von der
Formulierung des Wirkstoffs. Das gilt auch für die Aufnahme über
den Magen-Darm-Bereich. Z.B. erwies sich in Maisöl gelöstes
Permethrin im Fütterungsversuch an Ratten gegenüber in Wasser
gelöstem Permethrin als sechsmal so giftig
[66]
.
Reizerscheinungen der äußeren Haut und Schleimhaut:
"Kontakt-Dermatitis", vorwiegend im Gesicht; Augenbrennen; schmerzhafte
Wahrnehmung von Sinnesempfindungen; krankhaft abnorme Sinnesempfindungen,
wie z.B. Kribbeln, Taubheit, Reizungen
Das Hirn betreffend
zerreißende Kopfschmerzen; Schwindel; lähmende Müdigkeit;
Schlafanfälle abwechselnd mit innerer Unruhe, depressiver Verstimmung
oder Niedergeschlagenheit
Magen und Darm betreffend:
Übelkeit; Erbrechen; anhaltende Durchfälle; krampfartige
Bauchschmerzen
Vegetative Regulationsstörungen
Schweißausbrüche; Herzjagen
Blutbildungs-, Gerinnungs-Störungen:
Blutergüsse auf der Haut; Blutharnen
(nach Brinkmann und Müller-Mohnssen
[67])
Neurotoxisches Syndrom: Beeinträchtigung der intellektuellen
Leistungsfähigkeit mit Konzentrationsstörungen, mangelndes
Durchhaltevermögen bei konzentrativer Arbeit, Minderung sprachlich-kommunikativer
Kompetenz (z. B: Silbenverdrehung und Benutzung unscharfer Termini), Verlust
von Lebensfreude, mürrisch-depressive Lebenseinstellung mit Folge
sozialen Rückzugs.
Permethrin:
Allgemeine Eigenschaften:
rel. Molekülmasse: 391,29
Schmelzpunkt [ grad C]: 34,35
Siedepunkt [ grad C]: --
Dampfdruck (bei 20 grad C) [hPa]: 4,5 x 10(-4)
Permethrin:
______________________________________
MAK-Wert: nicht festgelegt
Spitzenbegrenzung: --
______________________________________
_______________________________________________________
Wirkstoff LD(50) NOEL ADI
[mg/kg] [mg/kg KG] [mg/kg KG/d]
(Ratte, or.)
_______________________________________________________
Permethrin 1750 -- --
_______________________________________________________
Bewertung von belasteten Innenräumen: (Bremer
Umwelt-Institut
[68]
)
1. Hausstaubproben:
__________________________________________________________
Pyrethroidkonzentration Bewertung
[mg/kg]
__________________________________________________________
bis 3 geringe Belastung
3 - 30 deutliche Belastung
30 - 100 hohe Belastung
ueber 100 sehr hohe Belastung
___________________________________________________________
Ein großes Problem bei der Bewertung von Staubproben liegt
in der mangelnden Normierung des Probennahmeverfahrens . In einem zu
begutachtenden Fall lagen drei scheinbar sich widersprechende Staubwerte
mit Pyrethroidbelastung vor, die um einen Faktor 1000 differierten, was
darauf zurückzuführen war, daß Proben von gering belasteten
und hoch belasteten Flächen genommen worden waren, ohne vor der
Probennahme genaue Festlegungen des Probennahme-Ortes vorzunehmen.
Ab Werten von 5-10 mg/kg Hausstaub und gleichzeitigem Auftreten entsprechender
Symptome sollte durch eine Untersuchung eines sachvertsändigen
Arztes ein möglicher Zusammnenhang der Gesundheitsbeschwerden
mit einer Pyrethroidvergiftung untersucht werden.
2. Flächenbelastung:
___________________________________________________________
Pyrethroidkonzentration Bewertung
[mcg/qm]
___________________________________________________________
10 - 100 geringe Belastung
100 -1000 deutliche Belastung
1000 - 10.000 hohe Belastung
ueber 10.000 sehr hohe Belastung
___________________________________________________________
Vom Hersteller empfohlene Anwendungskonzentrationen für Langzeitpyrethroide
liegen bei 10.000 bis 30.000 mcg/qm, also wesentlich höher. Der
höchste vom Bremer Umweltinstitut gemessene Wert einer Wischprobenuntersuchung
im Zsh. mit einer Pyrethroidebelastung liegt bei 600.000 mcg/qm
[69]
.
3. Sanierungsmethoden:
- Entfernung der Schädlingsbekämpfungsmittel-Rückstände
aus den belasteten Räumen durch komplette Entfernung der behandelten
Gegenstände
- Entfernung der Schädlingsbekämpfungsmittel-Rückstände
durch Reinigung der belasteten Gegenstände. Dazu kommen prinzipiell
drei Methoden in Betracht:
- Reinigung durch Entfernung der Schadstoffe:
Hand- oder Maschinenwäsche (Textilien) mit Dekontaminationsmittel
auf Wasserbasis
- Reinigung durch Zerstörung der Schadstoffe:
chemisch durch nichtwässrige Dekontaminationsmittel
- Photochemisch durch Anwendung von UV-Strahlung
Zur Wirksamkeit der verschiedenen Methoden wurde im Bremer Umweltinstitut
eine Studie durchgeführt In den dabei untertsuchten Fällen
führten weder die Reinigungsversuche mit Dekontaminationsmittel
auf Wasserbasis, noch andere chemische Mittel zum gewünschten Erfolg.
Lediglich die photochemische Methode mit UV-Strahlung hatte teilweisen
Erfolg, hatte aber auch verschiedene Nachteile:
- Nur Rückstä,nde, die von der UV-Strahlung erreicht werden,
werden auch abgebaut.
- Bestrahlte Materialien werden z.T. verändert oder zerstört:
Textilien bleichen aus, Kunststoffteile können rissig oder spröde
werden.
- Die Methode ist gefährlich in der Anwendung: es kommt zu Ozonbildung
und UV-Strahlung. Schutzmaßnahmen sind erforderlich.
- Beim photochemischen Abbau kommt es zur Bildung von Abbauprodukten
unbekannter Struktur und Giftigkeit.
Die gründlichste und sicherste Methode stellt daher die vollständige
Entfernung sämtlicher belasteter Materialien dar.
Grundsätzlich ist bei Anwendung eines Dekontaminationsmittels ein
speziell vom Hersteller für diesen Zweck getestetes und für
geeignet befundenes Mittel zu verwenden. Erfahrungen des Bremer Umweltinstitutes
zeigen allerdings auch hier mangelhafte Sanierungserfolge [bisher unveröffentlichte
Ergebnisse].
[12] R. Machholz, H.J. Lewerenz (Hrsg.): Lebensmitteltoxikologie.
Springer-Verlag, Berlin 1989
[20] K. Naumann, R. Wegler (Hrsg.): Chemie der synthetischen Pyrethroid-Insektizide.
Springer- Verlag, Wuppertal, Leverkusen 1981
[21] H. Fengsheng, W. Shaoguang, L. Lihui, C. Shuyang, Z. Zuowen,
S. Jinxiu: Archives of Toxicology 63 (1989), S. 54-58
[59] I. Klencke, M. Ruhnau, P. Stolz: Pyrethroide, Pestizide in
Innenräumen. Verein für Umwelt- und Arbeitsschutz e.V. und
Bremer Umwelt-Institut e. V.. Bremen (1994); beziehbar über:
Bremer Umwelt Institut e.V., Wielandstr. 25, 28203 Bremen
[66] I. Jäger-Mischke, V. Wollny: Pyrethrum und Pyrethroide
- Ein Beitrag zur Naturstoffdiskussion. Öko-Institut Freiburg (1988)
[67] R. Brinkmann, H. Müller-Mohnssen: Zum gegenwährtigen
Stand der Klinik der Pyrethroid-Vergiftung; Tischvorlage zur Fachtagung
Biozidanwendung und Gesundheitsgefährdung, 31.08 - 01.09.1992,
Universität Oldenburg (1992)
[68] P. Stolz: Analytik und Vorkommen von Pyrethroiden in Innenräumen
- Stabilität von Pyrethroiden in 2-3 jahre alten Staubproben; Vortrag
zur Informationsveranstaltung "Hausstaub-Pyrethroide" im Rahmen des
Umweltsurvey am 14.12.1993 im Bundesgesundheitsamt, Institut für
Wasser-, Boden- und Lufthygiene (1993)
Letzte Aktualisierung: 12/1995
 Folgende Derivate werden charakterisiert:
Folgende Derivate werden charakterisiert: Folgende Derivate werden charakterisiert:
Folgende Derivate werden charakterisiert: